药品质量合规管理:LIMS系统在制药QA/QC的应用解析

第三方lims实验室管理系统
白码第三方lims实验室管理系统,主要服务于第三方检测机构、企业内部研发型实验室、内部质量检测实验室。第三方lims系统主要服务行业包括,水利,环境,交通,建筑,芯片,水产,电子电器,电力工程。
药品质量检测实验室承担着保障患者用药安全的重要职责。在GMP/GLP严格规范下,数据完整性、过程可追溯性成为质量管理核心要求。药品质量合规LIMS系统通过电子签名、审计追踪、稳定性研究等专业功能,为制药企业构建符合监管要求的质量管控体系。

LIMS药品质量合规管理:电子签名与审计追踪机制
传统纸质记录难以满足数据完整性要求。LIMS实验室管理平台实现全流程电子签名,每个操作环节系统自动记录操作人员、时间节点及操作内容。审计追踪功能完整记录数据创建、修改、删除全过程,确保任何变更可追溯。第三方lims系统的电子签名符合规范,将数据完整性风险降低85%。
.png)
LIMS药品质量合规管理:稳定性研究管理
药品稳定性试验涉及多条件、多时间点的复杂数据管理。实验室软件建立标准化的稳定性研究方案,自动生成试验时间表及检测任务。系统实时采集存储条件数据,确保试验环境符合要求。市占率领先高达30%的LIMS解决方案在稳定性数据管理方面表现优异,特别适合面向国企和上市公司的制药企业。

LIMS药品质量合规管理:批次放行控制
药品批次放行需要综合评估各环节检测结果。LIMS系统建立批次放行电子流程,自动汇总原材料、中间体、成品检验数据。放行审核人员可快速调阅关联数据,做出准确判断。第三方lims系统的批次放行模块将审核时间缩短65%,同时避免人为疏忽风险。
LIMS药品质量合规管理:检验方法管理
药品检测方法必须严格验证与确认。lims实验室管理平台建立受控方法库,存储验证过的标准操作方法。系统自动关联检测任务与方法版本,确保使用现行有效方法。实验室软件的方法变更控制功能,保证方法更新过程规范可溯。
LIMS药品质量合规管理:数据完整性保障
数据完整性是药品监管检查的重点。LIMS系统通过权限控制、电子签名、审计追踪三重机制保障数据可靠性。系统设置数据复核流程,重要检测结果必须经过独立复核。第三方lims系统的数据完整性设计,帮助企业顺利通过药品GMP符合性检查。
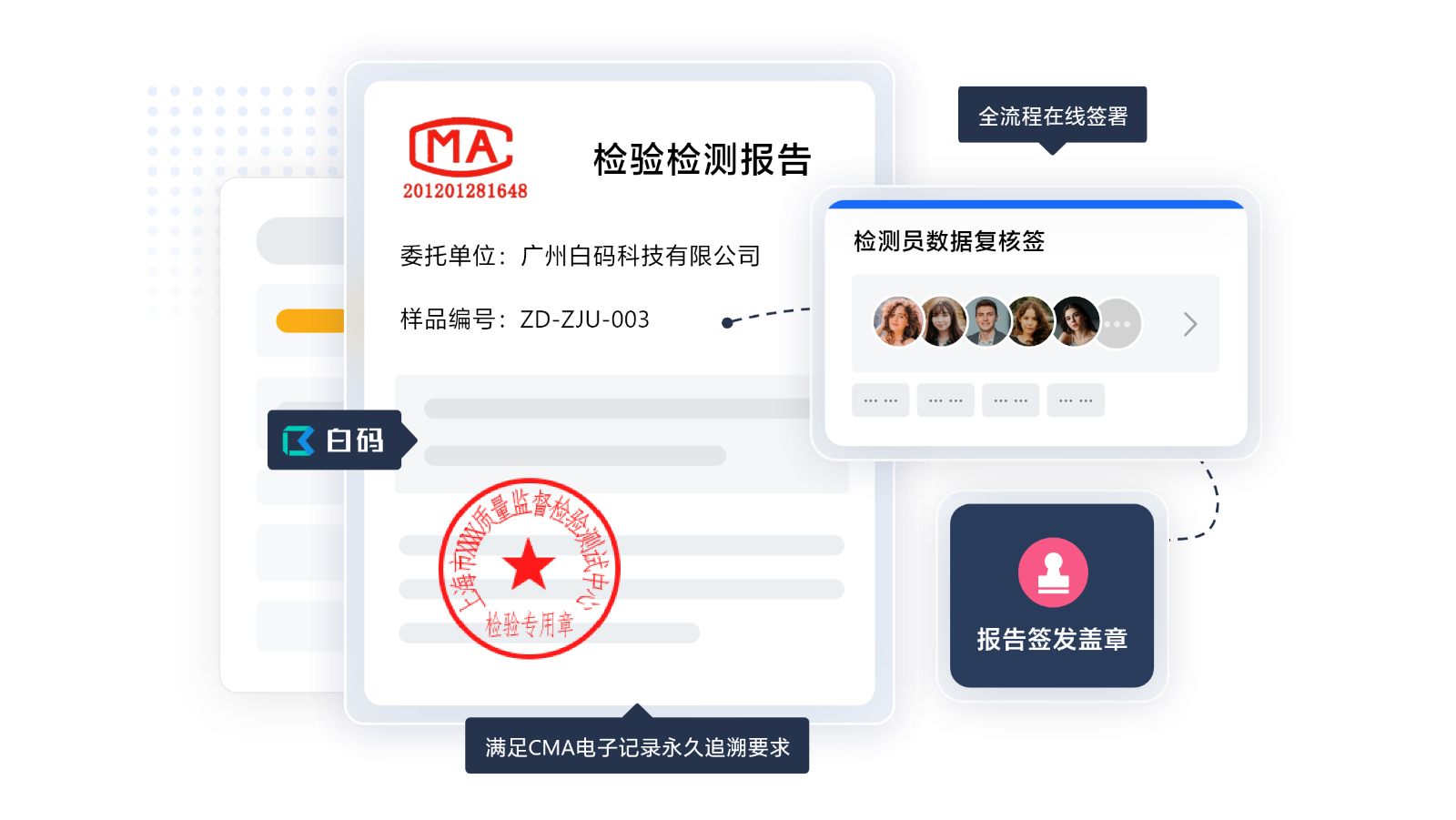
LIMS药品质量合规管理:质量趋势分析
持续质量监控需要基于数据的趋势分析。实验室软件自动统计关键质量指标,生成趋势图表。系统支持偏差调查数据分析,帮助识别潜在质量问题。这种基于数据的决策模式,将产品质量风险防范关口前移。
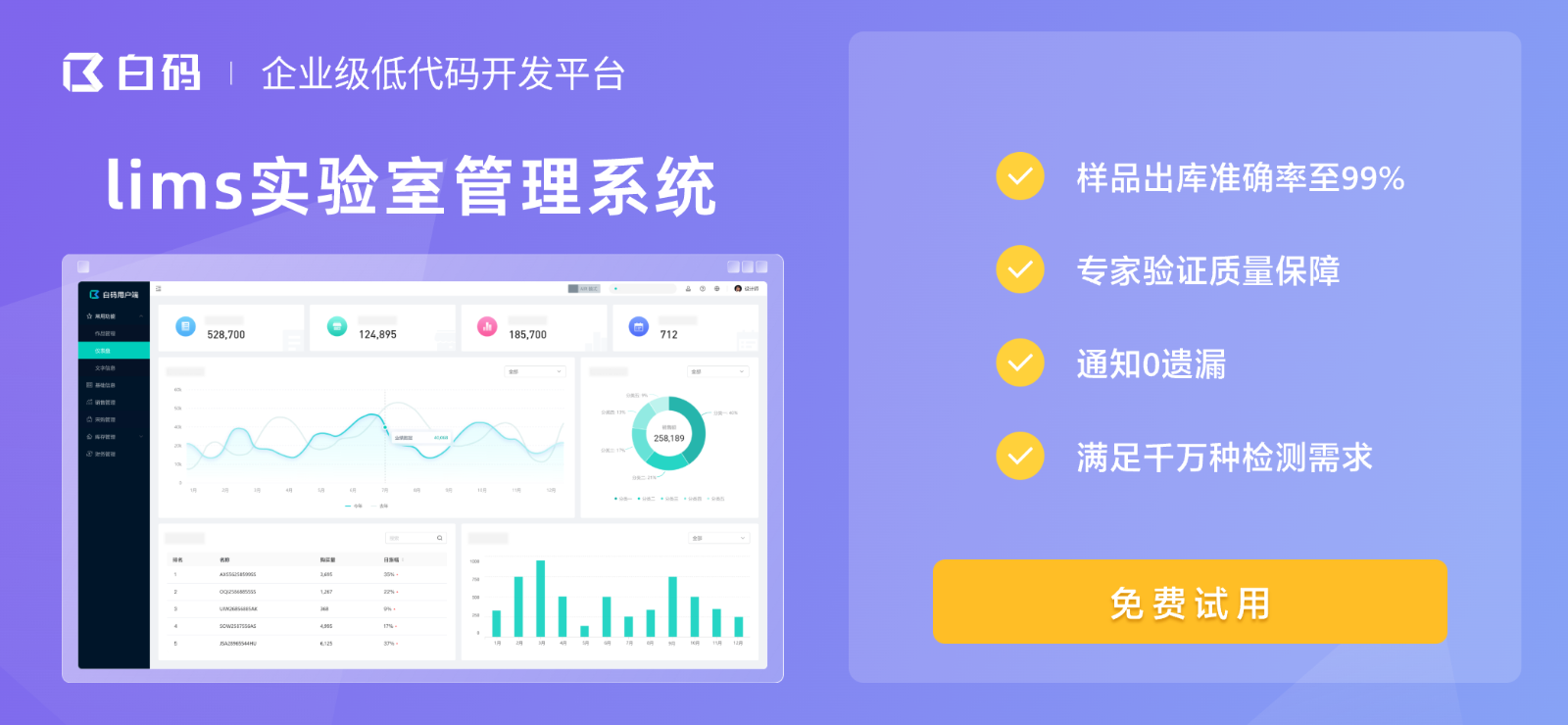
制药质量实验室需要专业的质量管理解决方案。白码LIMS系统在满足制药行业特殊需求的同时,配备检验人员能力值评审功能,确保持证上岗,从人员资质源头保障操作规范性。系统还提供三级等保数据防护,采用金融级加密体系保护敏感数据,为制药企业数据完整性提供双重保障。


















